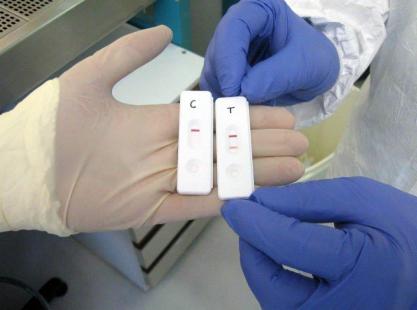
Dans une casette de la taille d’un ticket de micro, déposez une goutte de sang, de sérum ou d’urine sur une bandelette et voila ! C’est fini ! Dix à quinze minutes plus tard, une bande apparaît si l’échantillon contient plus de 100 000 copies du virus Ebola par millilitre. À partir du mois de novembre, plusieurs centaines de boîtes de test eZYSCREEN seront envoyées dans des centres de traitement guinéen pour un test de fiabilité sur le terrain. « Ce seuil de 100 000 virus/mL est un seuil de sensibilité analytique mesuré en laboratoire sur du sang normal que l’on a contaminé », précise le Dr Laurent Bellanger qui dirige le Laboratoire d’ingénierie cellulaire et biotechnologie à l’origine du test, « la sensibilité clinique est encore à évaluer sur le terrain. Notre test est validé techniquement, après des essais sur des échantillons sanguins normaux que l’on a contaminés, il faut maintenant l’essayer dans des centres de prise en charge sur le terrain avec des échantillons réels ».
Un projet de recherche militaire.
Ce test existe grâce à un anticorps monoclonal, développé depuis 2012 par l’équipe de Laurent Bellanger dans le cadre du programme de financement interministériel NRBC-E de 2005, dépendant du Ministère de la défense et du secrétariat général de la défense et la sécurité nationale. « Nous avons testé notre anticorps avec succès sur la souche Zaïre », raconte Laurent Bellanger, « puis, quand la souche actuelle a fait son apparition, nous avons découvert qu’il s’y fixait également ». La spécificité de l’anticorps a de plus été confirmée par son incapacité à se fixer sur le filovirus de Marburg, un proche parent d’Ebola. Une procédure d’industrialisation rapide est donc lancée mi août, en partenariat avec le laboratoire Vedalab, spécialiste des tests rapides, situé à Alençon. La production de plus de 300 kits de test au cours du mois d’octobre a été financée à la fois par le programme interministériel et par les fonds propres du CEA.
En complément de la PCR.
Il s’agit d’un test de diagnostic positif qui n’a pas vocation à remplacer la RT-PCR mais à la compléter. Si le test est positif, le patient peut être mis en isolement sans attendre. S’il est négatif, le diagnostic n’est pas exclu pour autant, car la charge virale est peut être inférieure au seuil de détection. « Cela va permettre de ne pas recourir systématiquement à une RT-PCR et soulager les laboratoire d’analyse » se réjouit Hervé Raoul, qui dirige le laboratoire P4 Jean Mérieux de Lyon.
Si l’évaluation du test sur le terrain se révèle positive, Vedalab s’est déclaré en mesure de produire 15 000 bandelettes sous quatre semaines, et 50 000 bandelettes sous six semaines. Présenté sous la forme d’un emballage unitaire le test devrait être stable pendant 18 mois à des températures oscillant entre 4° et 30 °C.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %