L’existence du biofilm a été mise en évidence dès 1676 par le Dr Van Leeuwnenhoek sur la plaque dentaire. Depuis les années 1970, il a fait l’objet de recherches au niveau des matériaux implantés dans l’organisme, mais son impact dans les plaies n’a véritablement attiré l’attention que dans les années 2000.
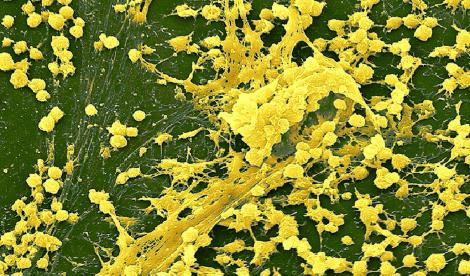
Le biofilm est une organisation bactérienne complexe : les bactéries créent une matrice multidimensionnelle hydratée constituée de protéines-glucides-acides nucléiques et lipides les protégeant des agressions extérieures. Il représente 90 % de la vie des bactéries. Il est généralement polymicrobien et en évolution constante in vivo dans les plaies, ce qui rend difficile l’évaluation des traitements.
Témoin ou conséquence de la chronicité des plaies ?
La matrice du biofilm entretient la réaction inflammatoire, délétère à l’évolution de la cicatrisation. Elle crée un micro-environnement qui réduit et inactive les antimicrobiens, favorise le transfert de gènes de résistance entre bactéries majorant leur virulence et inhibe la migration des kératinocytes. La présence d’un biofilm favorise la récurrence d’épisodes infectieux en particulier tardifs au-delà de 30 jours.
Le biofilm est surtout fréquent dans les plaies chroniques mais rare dans les plaies aiguës. Mais est-ce le fait que la plaie est recouverte de biofilm qu’elle est chronique ou est-ce la présence de facteurs de chronicité qui favorise le développement de biofilms ?
Le biofilm n’est pas visible à l’œil nu sauf sous forme de « slime » enduit blanchâtre et adhérent, à distinguer de la fibrine parfois épaisse et visqueuse plus jaune. Il ne peut être identifié qu’en microbiologie. Pour le détecter, certains ont imaginé un pansement intelligent qui en sa présence libérerait une substance fluorescente en quelques minutes, mais il ne sera pas disponible avant au moins 3 ans. On se tourne donc en pratique sur des arguments cliniques, un retard de cicatrisation alors que le traitement local et étiologique est bien conduit, des infections à répétition sur une plaie apparemment propre, la présence d’un « slime », etc., regroupés dans divers algorithmes.
Changer nos pratiques ?
« Nous ne disposons pas actuellement d’études cliniques prospectives randomisées pour modifier nos pratiques de façon radicale en intégrant la notion de biofilm », explique la Dr Meaume (hôpital Rothschild, Paris). Certains antimicrobiens ont montré une activité in vitro, mais ils ne sont pas tous disponibles ou remboursés en France. Les produits iodés sont peu efficaces à l’exception de l’Iodoflex. Un nouvel antiseptique à large spectre comme le Protonsan a un impact sur le biofilm à Ps. Aeruginosa ; les résultats avec les divers pansements à l’argent sont très inconstants, avec une certaine activité pour l’Aquacel Ag ou l’Urgoclean Ag. D’autres pansements pourraient avoir un intérêt comme le Sorbact, antibiofilm à SARM ou le Suprasorb X PHMB. Le traitement actuel du biofilm se conforme aux bonnes pratiques en soins des plaies, c’est-à-dire déterger pour diminuer la charge bactérienne du biofilm, rendre la matrice perméable aux antibactériens, prévenir sa reconstitution (rapide, en moins de 24 heures) en appliquant un antiseptique à large spectre et en renouvelant les soins au moins une fois par jour. Le biofilm est sensible aux traitements physiques, la détersion mécanique en particulier, mais aussi aux ultrasons, à la TPN ou à l’électrostimulation dont l’efficacité pourrait être renforcée par l’association à l’instillation d’antibactériens.
D’après la communication de la Dr Sylvie Meaume, gériatre/dermatologue, hôpital Rothschild (Paris) aux Journées Cicatrisation 2017 de la Société française et francophone des plaies et cicatrisations (SFFPC).

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %