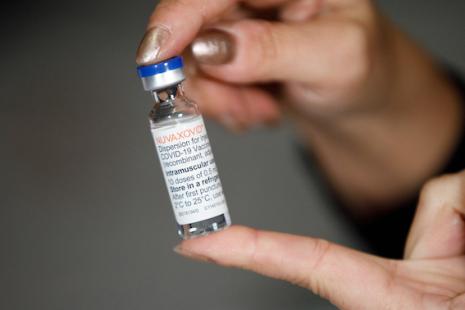
L’Agence européenne du médicament (EMA) recommande l’autorisation du vaccin Nuvaxovid (Laboratoire Novavax) adapté au sous-variant Omicron XBB.1.5.
La campagne de vaccination contre le Covid disposera - sous réserve de l’approbation de la Commission européenne - d’un nouveau vaccin adapté à l’Omicron XBB.1.5, sous-variant apparu en début d'année. Contenant une version de la protéine Spike d’Omicron XBB.1.5 associée à un adjuvant, Nuvaxovid présente la particularité d’être le seul vaccin adapté à ce sous-variant du SARS-CoV-2, à base protéique, sans ARN messager disponible en Europe pour les personnes âgées de 12 ans et plus. La seule alternative à la technologie à ARNm reste actuellement le vaccin VidPrevtyn Bêta (Sanofi). Celui-ci ne peut cependant être administré qu’aux adultes de 18 ans et plus, de surcroît ayant reçu en primo injection un vaccin à ARNm (Comirnaty de Pfizer-BioNTech ou Spikevax de Moderna) ou avec un vaccin à vecteur adénoviral (JCovden de Janssen ou Vaxzevria d’AstraZeneca).
En se prononçant en faveur de ce vaccin recombinant, l’EMA permet donc une immunisation des personnes réfractaires aux vaccins à ARNm. Sur la base des données cliniques disponibles, le profil d'innocuité du Nuvaxovid XBB.1.5 devrait être similaire à celui du Nuvaxovid, qui avait reçu l’aval de la Haute Autorité de santé (HAS) en décembre 2022 et disponible en pharmacie depuis le début d’année.
Les effets secondaires les plus fréquemment observés à la suite d’une vaccination par le Nuvaxovid XBB.1.5 sont des douleurs et une sensibilité au site de l’injection, de la fatigue, des maux de tête, des douleurs musculaires et un malaise général.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %